逆反应方向
逆反应方向的定义
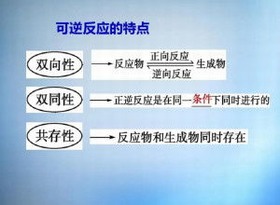 逆反应方向
逆反应方向逆反应方向指在可逆化学反应中,反应物与生成物相互转化的反向过程。当正反应(反应物→生成物)达到一定程度后,生成物会重新转化为反应物,两者动态平衡时称为化学平衡。例如:
其中,表示正逆反应同时存在。
可逆反应与不可逆反应
可逆反应:
特点:在同一条件下,正逆反应均能进行。
示例:酯化反应(乙酸与乙醇生成乙酸乙酯和水)与其水解反应。
不可逆反应:
特点:反应单向进行到底,如燃烧反应()。
影响逆反应方向的因素
浓度:
增加生成物浓度会推动反应向逆方向进行(勒夏特列原理)。
温度:
吸热方向的反应随温度升高而增强。例如,(吸热)升温使平衡向生成方向移动。
压强(针对气相反应):
增大压强使反应向气体分子数减少的方向移动。如合成氨反应中,高压利于生成。
催化剂:
同等加速正逆反应速率,缩短平衡到达时间,但不改变平衡位置。
化学平衡与逆反应
动态平衡:
正逆反应速率相等时,各组分浓度不再变化,但反应仍在微观层面持续进行。
平衡常数(K):
反映平衡时生成物与反应物的浓度关系。若,正反应占优;则逆反应趋势更强。
实际应用示例
工业合成氨:
通过调整温度(约500℃)、压强(20-50 MPa)及循环未反应气体,提高氨产量。
人体内的缓冲体系:
如,逆反应方向调节血液pH值。
相关概念扩展
反应速率方程:描述正逆反应速率与浓度的关系。
自发反应方向:由吉布斯自由能(ΔG)判断,ΔG < 0时反应正向自发。
附件列表
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。
